Vol. 2° - XVIII.5.3.
Geni del pollo domestico clonati e sequenziati
Non è escluso che i geni del pollo domestico assommino a 50.000-100.000 e, a partire dal 1988, nelle banche geniche esistevano più di 350 sequenze di DNA mentre erano stati clonati più di 100 geni.
Naturalmente dobbiamo supporre che il numero di geni
clonati andrà aumentando grazie ai continui perfezionamenti tecnologici. I
geni sottoposti a sequenziamento appartengono alla categoria degli enzimi,
degli oncogeni, dei provirus endogeni e delle proteine tissutali. Vediamone
alcuni esempi.
5.3.a. Il cristallino
Nel corso dello sviluppo, per
effetto di una serie di fenomeni di induzione, l’ectoderma di rivestimento
prospiciente il calice ottico si invagina. Tale invaginazione ha forma di
doccia aperta verso l’esterno che in seguito si chiude a formare una
vescicola. La vescicola diventa peduncolata e si rende indipendente dall’epitelio
d’origine per costituire l’abbozzo del cristallino, accolto nella
concavità del calice ottico. Le cellule presenti al margine, o equatore dell’abbozzo,
insieme a quelle della faccia posteriore, aumentano progressivamente in
altezza e ne invadono la cavità, prima riducendone il lume ed infine
raggiungendo l’epitelio più superficiale di tipo cubico semplice.
Al termine del differenziamento il cristallino è
trasparente, ha forma di lente biconvessa e mette a fuoco le immagini sulla
retina mediante variazioni del raggio di curvatura. A livello della faccia
anteriore è costituito da un epitelio cubico semplice, presenta nel suo
contesto le cosiddette fibre del cristallino che originano dagli elementi
della faccia posteriore, ed è circoscritto dalla capsula o cristalloide.
Le fibre hanno forma di prismi esagonali e sono separate
da spazi molto ridotti, pari a 15 nm; nel citoplasma, finemente granulare, si
osservano rari mitocondri e piccole vescicole. I desmosomi sono sporadici, ma
nelle sedi maggiormente sottoposte a deformazioni si riscontrano complicate
interdigitazioni di membrane di fibre adiacenti, che si ritiene siano
associate ai cambiamenti morfologici conseguenti l’accomodamento dell’immagine.
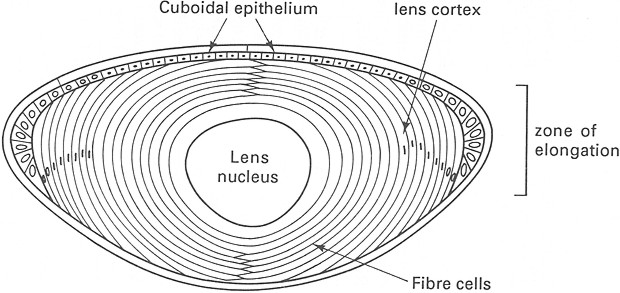
Fig. XVIII. 6 – Disposizione delle cellule in seno al cristallino
La graduale transizione fra epitelio cubico e fibre si
trova in corrispondenza dell’equatore, cioè del piano frontale massimo del
cristallino, e viene indicata come zona
dei nuclei perché a questo livello
sono ben evidenti i nuclei degli elementi cilindrici che hanno dato origine
alle fibre stesse. I nuclei mancano invece nella parte centrale, a livello del
cosiddetto nucleo del cristallino.
La capsula o cristalloide corrisponde alla membrana basale
dell’abbozzo invaginato. È uno strato laminare omogeneo, costituito da
glicoproteine e da collagene atipico, che circoscrive completamente il
cristallino.
5.3.b. Cristalline
Le cristalline sono le proteine
principali presenti nella lente o cristallino
dell’occhio, dove rappresentano circa l’80-90% delle
proteine solubili totali. Esse spiegano quasi completamente le proprietà rifrattive dell’occhio.
La capacità della lente di mettere a fuoco i raggi luminosi sulla retina
dipende dalla concentrazione e dalla posizione delle diverse molecole di
cristalline comprese tra le fibre lenticolari, a loro volta derivate dal
progressivo allungamento delle cellule epiteliali. Esistono quattro principali
famiglie o tipi di cristalline, a - b - g - d, e
alcune famiglie meno comuni, e
- r - t.
q
Tutti
i vertebrati hanno le cristalline a e b, ma la cristallina g presente nei mammiferi è
sostituita negli uccelli e nei rettili dal tipo d.
q
La cristallina e
è il componente maggiore delle lente dell’anatra, la r
è presente nella rana, la cristallina t
è stata trovata nella tartaruga e nella lampreda.
Ogni cristallina ha proprietà
immunologiche diverse nonostante il sequenziamento mostri delle omologie tra
la b e la g, che vengono perciò
raggruppate come una superfamiglia. Esistono almeno 2 tipi di a, 7 tipi di b e g unite insieme, e 2 tipi di d.
Le ragioni per studiare le proteine della lente sono
numerose, in quanto questa parte dell’occhio è quasi completamente
costituita da cellule fibrose derivate da un unico tipo di cellule epiteliali.
Dal momento che nella lente le cristalline sono abbondanti, gli mRNA
predominanti nelle cellule epiteliali saranno quelli deputati alla sintesi
delle cristalline. La struttura di queste molecole è interessante in quando
spiegano l’elevata capacità rifrattiva delle cellule e non causano il
fenomeno della diffusione della luce in modo apprezzabile come accade per le
soluzioni proteiche concentrate. Questa necessità fisiologica ha imposto
delle costrizioni alla loro evoluzione per cui sono
nettamente conservate.
La presenza negli uccelli della cristallina di tipo d
può essere in rapporto alla loro acuità visiva che necessita di un’ampia
accomodazione, che a sua volta richiede una lente soffice e facilmente
deformabile, molto idratata.
Tra gli uccelli, il pollo domestico è stato studiato in
modo più dettagliato: nei Galliformi la cristallina rappresenta più del 50% delle cristalline ed è nettamente
separata dalle altre cristalline in quanto non possiede residui di cisteina,
bensì leucina in abbondanza e un elevato contenuto di a
elica. Sempre nel pollo, la cristallina d
è stata quella più studiata: è la prima ad essere presente nel cristallino
dell’embrione di 4 giorni, per crescere progressivamente fino a raggiungere
un plateau al 19° giorno, mentre
dopo la nascita la sua sintesi diminuisce, tant’è che tra il 3° e il 5°
mese di vita l’mRNA per la cristallina d
scompare dalle cellule delle fibre. A causa della sequenza temporale della sua
sintesi, la maggior parte della cristallina d
si trova concentrata nel nucleo della lente.
È stato dimostrato che la cristallina d è presente in due forme non alleliche.
Le sequenze dei due
geni
d1 e d2 sono altamente omologhe - circa
90% di omologia - e sono disposte in tandem sul
cromosoma, separate da 4 kb di sequenza intergenica. Ambedue i geni posseggono
17 exoni e 16 introni e, in seguito alla conoscenza di queste raffinatezze, è
possibile esaminare in dettaglio il controllo della loro espressione.
L’RNA messaggero isolato dalla lente del pollo domestico
sembra contenere l’mRNA per la d1 ma non per la d2, suggerendo così che il primo
gene dev’essere molto più attivo del secondo.
Anche l’anatra ha due geni simili per la cristallina d,
per cui si può pensare che la duplicazione del gene si sia verificata prima
della divergenza delle specie aviarie.
La cristallina
a
è l’ultima ad essere sintetizzata durante la vita embrionale del pollo e il
gene che ne è responsabile è composto da 3 exoni e da 2 introni.
Un riscontro inaspettato circa la struttura delle
cristalline è la loro relazione con le altre proteine. La cristallina a somiglia moltissimo a un gruppo di proteine note
col nome di
proteine da shock di calore,
che possono avere un certo numero di funzioni in seno alla cellula. La
superfamiglia delle cristalline b
e g è simile alla proteina del
mantello della spora batterica legante il calcio, ma la relazione più
sorprendente è forse quella che le cristalline hanno con certi enzimi metabolici,
tra i quali possiamo annoverare l’ASL (argininsuccinatolisasi), la lattato
deidrogenasi, la glutatione S-trasferasi e varie reduttasi NADPH
[1]
dipendenti. Queste somiglianze suggeriscono la possibilità che lo stesso gene
codifichi ambedue le funzioni, quella della lente e quella metabolica.
La cristallina d
del pollo domestico e l’enzima ASL, importante nel ciclo dell’urea, sono
molto simili, e quella dell’anatra ha un’elevata attività ASL, mentre
quella del pollo è modesta. Piatigorsky (1988) ha dimostrato che il cDNA della
cristallina d1 del pollo e il DNA genomico umano si ibridano con il gene dell’ASL
umana (da notare che i mammiferi, uomo incluso, non hanno la
cristallina d). Questi dati
insieme ad altri, che non è il caso di citare, sulla somiglianza tra
le cristalline e le altre proteine non correlate dal punto di vista
funzionale, suggeriscono l’ipotesi secondo cui esse sono derivate da un
processo di evoluzione divergente.
Le cristalline si sono
evolute molto lentamente, con un cambiamento di
sequenza pari a solo il 3% in 108
anni. Questo fatto, come già
accennato, può essere in parte giustificato da un’elevata pressione
selettiva, cioè una selezione per due tipi distinti di lenti e di funzioni
enzimatiche. Il tutto è particolarmente interessante in relazione alla teoria
neutralista dell’evoluzione e della deriva genetica casuale. Una deriva
casuale sembrerebbe meno probabile se i geni si evolvono in vista di funzioni
molteplici.
5.3.c. Proteine contrattili
Nei processi di contrazione sono
coinvolte direttamente o indirettamente alcune proteine, presenti nelle fibre
muscolari o in altre cellule dell’organismo. Nel secondo caso hanno il ruolo
di mantenere o di variare la forma della cellula, nonché di formare il fuso
durante la mitosi. Si pensa che la maggioranza delle proteine contrattili del
muscolo possano essersi evolute dagli stessi tipi ancestrali come è accaduto
per quelle presenti nel citoscheletro degli altri tipi cellulari.
Actina
L’a actina è presente solo nelle cellule muscolari, mentre b
actina e g actina si riscontrano in tutte le cellule dell’organismo.
Tutti e tre i tipi sono stati sequenziati, e l’a actina differisce dalle altre
due nella sequenza dell’estremità N e per il fatto di avere un punto
isoelettrico minore.
In seno ai tipi base esistono tuttavia delle
eterogeneità, tant’è che nel pollo domestico esistono almeno 6 tipi di
actina e non si può escludere l’esistenza di ulteriori componenti minori.
Queste 6 forme includono tre tipi di a
actina e due di g actina. Le prime sono
state sottoposte a sequenziamento e si è visto che esistono scarse differenze
tra quelle del muscolo cardiaco, della muscolatura scheletrica e della
muscolatura liscia. Possiamo aggiungere che la g
actina del ventriglio
del pollo domestico è diversa da quella delle cellule non muscolari.
Pertanto, analizzando il DNA deputato alla sintesi dell’actina,
dovremmo aspettarci di trovare almeno 6 geni. I risultati ottenuti mediante
tecniche di ibridazione del cDNA, a sua volta derivato dall’mRNA, dimostrano
che esistono 10-11
copie di geni per genoma.
Mentre gli elementi promotori sono fondamentali per
determinare se la trascrizione debba avvenire oppure no, gli enhancers,
o elementi di intensificazione, sono necessari per ottenere il massimo grado
di trascrizione per un determinato gene. Un enhancer
ha una funzione di aiuto nel controllo della trascrizione esercitato dal
promotore al quale è legato, anche se può trovarsi a parecchia distanza,
talora ad oltre 1.000 bp. Nelle cellule animali gli enhancers sono in grado di attivare i geni sia che si trovino a
monte, sia che si trovino a valle del punto d’inizio dell’RNA e anche
quando si trovano all’interno della sequenza codificante. Nel lievito ci
sono tre elementi funzionalmente simili agli enhancers,
detti sequenze attivatrici a
monte, upstream activator
sequences o UAS,
le quali, come gli enhancers possono
funzionare in entrambi gli orientamenti e a distanza variabile dal promotore.
Al fine di poter studiare la regione regolatrice, o
regione del promoter,
dei geni strutturali dei vari tipi di actina, furono inseriti frammenti
della sequenza attivatrice a monte
in un vettore, riuscendo così a dedurre quante UAS appartenenti al gene
strutturale sono necessarie per la sua espressione e qual è l’entità della
potenza del promotore. Un promotore forte è in grado di rendere il gene strutturale capace di
esprimersi più frequentemente, per cui nella cellula troveremo una maggior
quantità di prodotti derivati da tale gene. Il promoter della b
actina è quello più potente e ciò concorda col riscontro dell’abbondanza
di b actina in parecchi tipi
cellulari.
Miosina
La miosina è una molecola lunga
150 nm spessa circa 3 nm, è la proteina più abbondante del muscolo
scheletrico, esamero con peso molecolare totale di 500.000 Da, composto da due
catene pesanti, ciascuna con peso molecolare 200.000 e da due paia di catene
leggere con peso molecolare pari a 20.000 Da per ciascuna catena.
Due catene
leggere, LC1
e LC3, sono state sequenziate e si è visto che la
disposizione dei relativi geni è piuttosto inabituale: un singolo gene
composto da 9 exoni e da 8 introni codifica per ambedue le proteine. Gli exoni
1-4-5-6-7-8-9 codificano per l’mRNA di LC1
mentre gli exoni 2-3-5-6-7-8-9 codificano
per l’mRNA di LC3.
Troponine
Dal muscolo scheletrico del
pollo domestico è stato clonato e sequenziato un terzo gene, quello per la troponina I. La troponina fa parte del
sistema di regolazione del muscolo scheletrico, forse impedendo lo scorrimento
delle teste miosiniche nelle docce actiniche. Tutte le sequenze geniche
relative alle varie troponine mostrano un’estesa omologia, per cui si pensa
che l’espressione dello sviluppo delle proteine muscolari debba sottostare a
un controllo coordinato.
Tubuline
Le tubuline sono proteine che
fanno parte del citoscheletro, deputate alla formazione del fuso mitotico e
meiotico nonché al processo di allungamento delle cellule nervose. Insieme
alle actine determinano le modificazioni di forma della cellula eucariotica.
Due tipi distanti di monomeri, a tubulina e b tubulina, costituiscono un eterodimero che a sua volta si
polimerizza per dar luogo ai microtubuli che percorrono da un capo all’altro
la cellula eucariotica. La maggioranza dei lavori concernenti le tubuline sono
stati compiuti sull’embrione di pollo, precisamente sul tessuto cerebrale.
Gli ultimi dati indicano che nel pollo domestico i geni delle tubuline sono dispersi su vari cromosomi,
e che esiste una
famiglia per la b tubulina costituita da 7 geni,
attualmente tutti sequenziati, e di essi almeno due si trovano sul cromosoma
2. Alcuni si esprimono di preferenza in alcuni tessuti nel modo seguente:
o
b-1 nel muscolo scheletrico
o
b-2 nel cervello
o
b-3 prevalentemente nel testicolo, ma anche in altri tessuti
o
b-4 nei neuroni
o
b-5 in piccola quantità nella maggior parte delle cellule, assente nei
neuroni
o
b-6 nei microtubuli delle cellule emopoietiche
o
b-7 nella maggior parte delle cellule
Ognuno dei geni per queste b tubuline ha un’unica
modalità di espressione durante lo sviluppo.
I geni dell’a
tubulina si trovano dispersi su 4 differenti cromosomi, e di essi uno si trova
sul cromosoma 1 e un altro sul cromosoma 8. Per ora sono state descritte almeno 7 diverse a tubuline. Siccome il numero delle isoforme sembra maggiore
del numero dei geni, si pensa che alcune forme siano il risultato di
modificazioni post traduzionali.
5.3.d. Collageni
Il collagene è la proteina più
abbondante dell’organismo in quanto è virtualmente presente in tutti i
tessuti. Come dice la parola, il collagene ha la funzione di incollare, di determinare una coesione tra i vari componenti di un
tessuto. Fa eccezione il sangue, in cui la sostanza collagene è assente, in
quanto si tratta di un tessuto con matrice intercellulare liquida, e ciò al
fine di poter circolare liberamente nei vasi sanguigni.
Il collagene, insolubile, viene sintetizzato nelle cellule
sotto forma di precursore, il procollagene, che è solubile. Viene poi secreto
e modificato al fine di generare la matrice intercellulare. Esistono vari tipi
di collagene, differenti in base alla grandezza delle unità che vengono
polimerizzate e alla disposizione spaziale di ogni unità in seno alla
matrice.
Le
forme tipiche hanno una
disposizione
a
elica tripla delle
catene polipeptidiche che compongono circa il 90%
della
struttura totale. La glicina è presente ogni 3 residui aminoacidici, e tra
gli aminoacidi più frequenti troviamo prolina, alanina e serina. I tipi
differenti di collagene sono numerati in romano da I a X. Il tipo I è il più abbondante (90%).
Esistono
due geni deputati alla sintesi
dei suoi due precursori, il
procollagene a1 e
a2. Nel pollo domestico il
collagene di tipo I è stato quello più studiato e i geni dei suoi due
precursori sono stati ambedue clonati. Anche il tipo VI è stato clonato nel
pollo.
Si suppone che il collagene
provenga da una sequenza primordiale di 9 bp
che si è triplicata in 27 bp e che quindi si è condensata in 54 bp. La
sequenza di 9 bp corrisponderebbe alla sequenza ripetitiva di aminoacidi
presente nella tripla elica. Il residuo di glicina in ogni terza posizione
dell’elica tripla è essenziale per garantire stabilità alla molecola, e
ciò necessita di un meccanismo preciso nella reazione di escissione degli
introni. Nonostante la pro-a1(I)
e la pro-a2(I)
siano polipeptidi coespressi ed interdipendenti, essi differiscono in modo
sostanziale per la loro sequenza aminoacidica dovuta alle differenze circa la
posizione del terzo codone che per pro-a2(I)
è U, sostituito da C in pro-a1(I).
5.3.e. Cheratina
La cheratina è il principale
prodotto genico dei tessuti epidermici. È la proteina predominante dei peli,
dei capelli, della lana, delle piume, degli artigli, delle unghie e del becco,
per cui riveste grande importanza negli uccelli.
Le
b cheratine presenti nelle piume comprendono almeno 20 proteine differenti,
prodotte da una famiglia
multigenica. Presland (1989) ha
clonato e sequenziato 4 di questi geni, dotati di un alto grado di
somiglianza, e che si esprimono nel tessuto della piuma a partire dal 14°
giorno di vita embrionale. Successivamente è stato clonato un grappolo di 18
geni per la cheratina delle piume, affiancato da ciascun lato da altri geni
per la cheratina, inclusa quella delle squame.
5.3.e. Proteine dell’uovo
Proteine dell’albume
Esistono degli aspetti
particolarmente interessanti connessi alla clonazione e al sequenziamento
delle proteine dell’albume:
q queste proteine sono in maggioranza sintetizzate dalle cellule delle ghiandole tubulari dell’ovidutto e si trovano tutte sotto controllo ormonale
q la struttura delle proteine più importanti è stata analizzata da cima a fondo.
I geni finora studiati sono
quelli per l’ovalbumina, l’ovotransferrina (o conalbumina), l’ovomucoide,
il lisozima e l’avidina. Nonostante la loro sintesi sia sotto controllo
ormonale, la risposta è variabile a seconda della proteina.
L’estradiolo
causa un rapido incremento dell’mRNA per l’ovotransferrina, mentre l’incremento
per quello dell’ovalbumina è un po’ ritardato. Questo fatto può essere
legato al differente fiancheggiamento delle sequenze in quei geni che
interessano l’efficienza del promotore. Comunque, i geni contengono degli
introni il cui numero è irregolarmente proporzionale alle dimensioni della
proteina. Per fare due esempi, il lisozima e l’ovotransferrina, con peso
molecolare rispettivamente pari a 14.300 e a 80.000 Da, hanno i rispettivi
geni contenenti 4 e 17 exoni.
Due geni,
X e Y, strettamente correlati al gene deputato alla sintesi
dell’ovalbumina, sono anch’essi sotto il controllo degli ormoni steroidei.
I geni X e Y, insieme al gene dell’ovalbumina, sono contenuti in un
frammento di DNA di 46 kb e si pensa che siano derivati da duplicazione
genica. Ognuno di essi è composto da 8 exoni che differiscono solo per le
dimensioni della regione non tradotta. Ambedue sono espressi nella gallina in
fase depositiva, ma ad un livello più basso rispetto all’espressione del
gene per l’ovalbumina, in quanto il loro mRNA è pari solo al 2% dell’mRNA
per l’ovalbumina. In vitro, l’mRNA dei geni X e Y è stato tradotto e le
proteine derivanti sono distinte dall’ovalbumina.
La sequenza completa del gene per l’ovalbumina rivela quanto sia abbondante la
quota di introni paragonata con le aree codificanti: in totale si tratta di
7.564 b (basi), delle quali solo 1.872 rappresentano la sequenza codificante.
Il gene per l’ovomucoide
è composto da 5,6 kb mentre la zona codificante contiene solo 812 b. Si pensa
che il gene per l’ovomucoide sia derivato da un processo di duplicazione
genica, dal momento che è costituito da 3 dominî simili. La regione
codificante di ognuno di questi dominî è separata da un introne. Tuttavia
esistono 7 introni, e l’exone più breve è di sole 20 b. Per i geni finora
sequenziati, si è visto che le dimensioni delle aree degli introni sono
maggiori rispetto a quelle degli exoni.
Proteine del tuorlo
Le vitellogenine costituiscono la famiglia maggiore dei precursori
delle proteine del tuorlo
e
vengono sintetizzate nel fegato in risposta allo stimolo estrogenico. Si tratta di proteine di grandi dimensioni,
circa 200.000 Da, immagazzinate in modo selettivo dall’oocita di gallina in
via di sviluppo, per essere successivamente scisse in lipovitellina e fosvitina,
accumulate nel tuorlo sotto forma di granuli che serviranno a nutrire l’embrione
in via di sviluppo. Esistono 3 geni separati che codificano per le vitellogenine e sono stati
isolati 3 distinti polipeptidi, siglati VtgI, VtgII e VtgIII, dei quali VtgII è il più abbondante. È stata
determinata la sequenza completa del gene per VtgII, composto da 20.342 bp che
comprendono 35 exoni. Anche il gene per la VtgIII è stato clonato e sia il
gene per VtgII che quello per VtgIII sono fiancheggiati da pseudogèni, YVtgII adiacente a VtgII e YVtgIII adiacente a VtgIII.
5.3.g. Istoni e protamine
Istoni
Gli istoni sono le proteine responsabili della disposizione compatta del DNA
in seno al cromosoma. Nelle cellule a rapida suddivisione la sintesi del DNA
si verifica durante la fase S,
accompagnata da una sintesi parallela di istoni che sono proteine altamente
conservate.
I geni responsabili degli istoni sono stati quelli più
precocemente studiati a livello molecolare, e uno dei motivi consiste nel
fatto che nel nucleo di certi organismi esistono parecchie copie di geni per gli istoni,
rendendo l’analisi più facile. Le copie possono essere 1.600 come nell’axolotl,
oppure solamente due come nel lievito. Si pensa che l’elevato numero di
copie di geni per gli istoni permetta una rapida divisione cellulare, come è
richiesta nel caso dello sviluppo embrionale, nonostante l’adulto conservi
tale abbondante dotazione. Nel
pollo esistono circa 10 copie di ogni gene per gli istoni.
Tutte queste copie multiple di un gene possono trovarsi disposte in vario
modo: a grappolo ripetuto in tandem, disperse in seno ai vari cromosomi,
raggruppate in piccoli grappoli. Studi recenti hanno messo in chiaro che nel
pollo si trovano raggruppati in grappoli
casuali e non sono ripetuti in tandem.
Uno degli aspetti più particolari dell’organizzazione
dei geni per gli istoni è il fatto che, rispetto agli altri geni degli
eucarioti, mancano generalmente di introni.
Una variante dell’istone H2A, nota come H2AF,
è stata sottoposta a sequenziamento nel pollo domestico e si è visto,
invece, che contiene 4 introni, come accade anche per la variante H3.3 sempre
del pollo. Un’altra caratteristica che queste due varianti condividono con l’istone
H5 è il fatto che la loro espressione è indipendente dal ciclo cellulare,
mentre gran parte della sintesi degli istoni è strettamente accoppiata alla
sintesi del DNA che si verifica nella fase S
del ciclo.
Protamine
Durante la spermatogenesi si
verifica una drastico cambiamento della struttura della cromatina e gli istoni
del core del nucleosoma vengono
completamente sostituiti da un altro gruppo di proteine basiche note come
protamine. Le protamine determinano
la compattazione della cromatina nucleare, sono proteine più
piccole degli istoni, con peso molecolare per lo più pari a 4.000÷7.000,
contenenti un’elevata quantità di arginina che è un aminoacido basico. Nel
pollo domestico sono presenti 2
loci
per la protamina, detta gallina
[2]
.
Ambedue i loci hanno regioni codificanti identiche e il numero di copie dei
geni assomma a due per ogni genoma aploide, cioè una copia per ciascun locus.
A differenza di quanto accade nei mammiferi che posseggono un introne per
locus, nel pollo nessuno dei due loci contiene introni, condividendo questa
caratteristica coi salmonidi, il cui significato evoluzionistico è ancora
oggetto di discussione e di indagine.
Dall’insieme dei dati
attualmente a nostra disposizione possiamo trarre le seguenti considerazioni
generali:
§
gli introni hanno
generalmente dimensioni estese, occupando spesso più della metà del gene
§
si verifica una
maggior conservazione della sequenza nucleotidica degli exoni rispetto a
quella degli introni
§
i geni che codificano
per proteine piccole, tipo gli istoni, mancano di introni
§
i geni che sono tra
loro correlati sono frequentemente, se non sempre, raggruppati sui cromosomi;
esempi di questi raggruppamenti sono forniti dai geni per le ovalbumine, gli
istoni, le d
cristalline, le immunoglobuline
§
le sequenze promoter
sono importanti nella regolazione dell’espressione genica durante lo
sviluppo.