Vol. 2° - XXVIII.9.
LE MELANINE CONTENEnTI ZOLFO
9.1. Feomelanine
Nonostante la letteratura
trabocchi di lavori riguardanti le melanine gialle, color tannino o marrone
rossastro presenti nei peli, nei capelli e nelle piume, solo pochi pigmenti di
questo tipo sono stati isolati al fine di dimostrare, attraverso l’analisi
chimica, che si tratta di feomelanine genuine.
Oltre a pochi esempi ben documentati, esistono dati che
inducono a presumere l’esistenza di feomelanine oltre che nelle piume rosse
o fulve di Gallus gallus, anche in
alcune razze di pollo domestico ![]() -
- ![]() quali l’Orpington fulva, nel tacchino varietà Bourbon e Jersey fulva, nei
peli di cavia, topo, cavallo, pecora e lama.
quali l’Orpington fulva, nel tacchino varietà Bourbon e Jersey fulva, nei
peli di cavia, topo, cavallo, pecora e lama.
La feomelanina è stata scoperta anche nella cute di pazienti con nevi displastici e, recentemente, anche nell’epidermide normale dei Caucasici bianchi con cute di tipo I, II e III.
Tuttavia, in base alle metodiche utilizzate, per ora
bisogna essere cauti nell’affermare la presenza di feomelanine nei tessuti
epidermici.
Da un punto di vista di biochimica comparativa bisogna
sottolineare il fatto che, a differenza delle eumelanine distribuite
ampiamente nel regno animale, le feomelanine sono state trovate solo nei mammiferi e negli uccelli.
In un certo senso, l’unica eccezione è rappresentata
dall’adenocromo, pigmento che ha relazioni con la feomelanina, presente nel
cuore branchiale di alcuni cefalopodi, come Octopus
vulgaris, dove determina un colorazione porpora. È quindi interessante
che ancora una volta i cefalopodi presentino caratteristiche biosintetiche
insolite per gli invertebrati.
9.1.a. Caratteristiche generali
Anche le feomelanine, come i
tricocromi, sono solubili
sia in alcali diluiti che in certi solventi acidi.
Questo comportamento è dovuto alla presenza di catene laterali di alanina
attaccate alle subunità che formano lo scheletro del pigmento. Non si conosce
molto circa lo stato di ossidoriduzione delle feomelanine, nonostante si pensi
generalmente che esse contengano delle unità strutturali con differenti
livelli di ossidazione, ma ciò necessita di una conferma.
Dal momento che le feomelanine naturali sono generalmente
associate a proteine, esiste la possibilità che si tratti di cromoproteine. A
favore di questo punto di vista Fattorusso (1968) ha riscontrato che le
proteine legate al pigmento sono diverse dalla cheratina della piuma per l’assenza
di cisteina tra i 16 aminoacidi ottenuti mediante idrolisi. Inoltre, la
proteina era fortemente legata al cromoforo di pigmento, suggerendo così l’esistenza
di un legame covalente.
Il peso molecolare risultante dall’ossimetria a
pressione di vapore si aggira intorno a 2.365, e per il pigmento di origine
corrisponderebbe a circa 1.800. Tuttavia, la struttura generale delle
feomelanine è poco conosciuta, e la più studiata è la gallofeomelanina delle piume rosse delle
femmine di New Hampshire, ma pigmenti analoghi sono stati trovati in altre
piume rosse e nei peli di mammiferi, strutturalmente simili, e differenti
forse solo per le dimensioni della molecola e per il contenuto proteico.
In ogni caso, queste feomelanine sembrano essere dei polimeri irregolari o miscele di polimeri che mancano di qualsiasi caratteristica spettrale o di qualunque caratteristica fisica ben definita. Nonostante esista il vantaggio teorico di aver a che fare con materiale alcali solubile, il problema strutturale è simile a quello presentato dalle eumelanine. Un dato assodato è il contenuto di azoto e zolfo nel rapporto 1:2.
Alla
costituzione del polimero partecipano sia unità di 1,4-benzotiazina a vari
livelli di ossidazione, che alcuni residui di cisteina non ciclizzata. Sono
stati distinti 4 frazioni di gallofeomelanina, numerate da 1 a 4, e la
gallofeomelanina 1 potrebbe essere costituita da una miscela estremamente
complessa di polimeri simili, in seno alla quale è possibile un certo grado
di variazione a seconda del numero e delle proporzioni relative dei vari tipi
di unità strutturali coinvolte.
9.1.b. Biosintesi delle feomelanine
Come nel caso delle eumelanine,
la conoscenza della biogenesi delle feomelanine ha preceduto gli studi
strutturali, e venne acquisita quando con i primi esperimenti la dopa venne
ossidata enzimaticamente in presenza di cisteina. In queste condizioni
sperimentali si ottenne un pigmento marrone-rossastro chimicamente simile alle
feomelanine estratte dalle piume delle femmine di New Hampshire.
Inoltre, quando l’ossidazione venne arrestata dopo poco il suo inizio ricorrendo all’acidificazione, in pochi minuti la soluzione giallo pallido virò al viola e fu possibile isolare piccole quantità di due pigmenti, identici sotto ogni aspetto ai tricocromi E ed F.
Da ciò è stato possibile arguire che feomelanine
e tricocromi possono formarsi in vivo attraverso una deviazione dal percorso
eumelanico attraverso l’aggiunta di cisteina al dopachinone
generato enzimaticamente dall’ossidazione della tirosina.
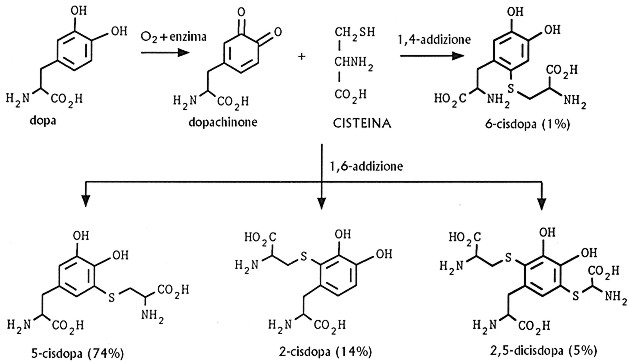
Fig. XXVIII. 4. – Formazione delle varie cisdopa per reazione fra cisteina e dopachinone
Questo cammino biogenetico è stato successivamente confermato dallo studio citochimico della formazione della feomelanina nella papilla delle piume di embrioni di NH. Come atteso, ambedue le forme marcate di cisteina e tirosina vennero incorporate dalle cellule produttrici di pigmento, mentre in presenza di un inibitore della tirosinasi l’incorporazione era praticamente nulla.
Prota (1967) è giunto alla conclusione che la reazione tra cisteina e 4-metil-o-chinone procede attraverso un’addizione in posizione 1,6 per dare come prodotto principale la cisteina metilcatechol, caratterizzata dalla spiccata tendenza all’ossidazione. La 5-cisdopa, simile al precedente composto, dovrebbe essere il prodotto intermedio nella sintesi delle feomelanine.
Ulteriori esperimenti hanno messo in evidenza che dalla reazione tra cisteina e dopachinone prendono origine altre cisdopa, e precisamente la 2-cisdopa, la 6-cisdopa, e la dicisdopa con due molecole di cisteina, e che ciascun prodotto contribuisce in proporzioni diverse alla biosintesi del pigmento naturale.
Così, per esempio, il tricocromo C, che potrebbe
derivare da due molecole di 5-cisdopa, è normalmente presente nei capelli,
nei peli e nelle piume rosse in concentrazione notevolmente maggiore rispetto
al tricocromo B, la cui formazione richiede, oltre alla 5-cisdopa, anche l’isomero
meno abbondante 2-cisdopa.
Allo stesso tempo, dalla degradazione delle
gallofeomelanine si è visto che il costituente principale è rappresentato
dalla 5-cisdopa. La presenza anche della 2-cisdopa e della 2,5-dicisdopa
rendono ragione del carattere eterogeneo delle feomelanine contenenti zolfo.