Vol. 2° - VI.4.
I RIBOSOMI
I ribosomi sono particelle
compatte, costituite da ribonucleoproteine, più o meno ancorate al versante
esterno delle membrane del reticolo endoplasmatico in quanto possono trovarsi
libere nel citoplasma. Nell’uno e nell’altro caso i ribosomi si associano quasi sempre in gruppi,
denominati poliribosomi o polisomi,
costituiti da 3 a 30 ribosomi legati da un esile filamento di mRNA.
Sono presenti in tutte le cellule procariotiche ed
eucariotiche. Assicurano la sintesi
delle proteine assemblando gli aminoacidi in una sequenza
predeterminata. Essi sono indispensabili per questi processi, dato che è solo
nello spazio compreso tra le due subunità ribosomiali che le interazioni tra
mRNA, tRNA e aminoacidi possono aver luogo, in modo da consentire la precisa
disposizione spaziale degli aminoacidi nel formare la proteina, la cui
sequenza è codificata a livello della sequenza nucleotidica dell’mRNA. La
correttezza di queste interazioni sembra dipendere in larga misura dall’organizzazione
molecolare del ribosoma.
La forma del ribosoma è universale: in sezione
longitudinale è leggermente ellittico. Le tecniche di colorazione negativa
[1]
mettono in evidenza un solco trasversale, perpendicolare all’asse maggiore
della particella, che divide il ribosoma in due subunità di dimensioni
diverse.
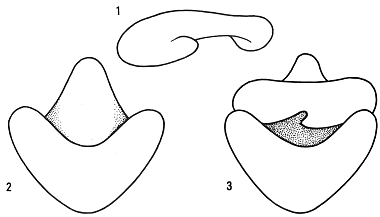
Fig.
VI. 2 - Il ribosoma.
1
subunità minore - 2 subunità maggiore - 3 ribosoma completo
Mediante ultracentrifugazione differenziale è possibile isolare le due subunità, delle quali si può così determinare la composizione. Le due subunità sono associate in maniera tale che il loro asse sia perpendicolare al solco che le separa: la somma delle lunghezze degli assi è uguale alla lunghezza dell’asse maggiore del ribosoma.
Ciascuna subunità è caratterizzata dal proprio
coefficiente di sedimentazione espresso in unità Svedberg
[2]
.
Così, il coefficiente di sedimentazione dei ribosomi nei procarioti è 70S
per il ribosoma intero (50S per la subunità maggiore e 30 per la subunità
minore) e negli eucarioti è 80S per il ribosoma intero (60S per la subunità
maggiore e 40S per la minore). Per difficoltà tecniche d’osservazione,
dimensione e forma dei ribosomi sono note in maniera molto imprecisa. Ancora
non si conosce bene il ruolo delle subunità.
|
Dimensioni dei Ribosomi |
|
Procarioti:
altezza 29 nm - larghezza 21 nm |
|
Eucarioti: altezza 32 nm - larghezza 22
nm |
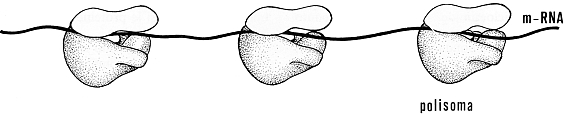
Fig. VI. 3 - Poliribosoma: rapporti tra le subunità ribosomiali e il filamento di mRNA
4.1. Funzione dei ribosomi: la protidosintesi
Durante la protidosintesi le
reazioni biochimiche utilizzano gli aminoacidi come materiale di partenza. Le
proteine sono formate dalla combinazione di 20 aminoacidi, la cui formula generale è H2N-CH-R-COOH, e sono macromolecole specifiche, vale a dire caratteristiche
della specie. In realtà, la specificità delle proteine va ben oltre, in
quanto esse sono specifiche non solo dell’individuo ma anche della cellula.
Le proteine differiscono fra loro per la disposizione degli aminoacidi: per
una determinata proteina di un dato individuo, l’ordine con il quale sono
disposti gli aminoacidi sarà sempre lo stesso. Vediamo come ciò può essere
spiegato.
Il
DNA
fornisce le informazioni necessarie alla sistemazione di un aminoacido in
posizione corretta nel concatenamento polipeptidico, ma l’acido nucleico si
trova nel nucleo, mentre la sintesi proteica avviene nel citoplasma con l’intervento
dei ribosomi che associano gli aminoacidi tra loro.
È dunque indispensabile che l’informazione genetica si
trasferisca dal nucleo al ribosoma. Tale trasferimento avviene grazie a una
molecola di mRNA
che funge da messaggero.
Le informazioni contenute nel DNA vengono trascritte sotto forma di RNA. La trascrizione è la sintesi di una
copia complementare di un filamento di DNA sotto forma di una molecola di
mRNA, che porta l’informazione genetica del DNA.
Il ribosoma ha come funzione essenziale quella di leggere
il messaggio proveniente dal DNA e di tradurlo, e la traduzione consiste nella
sintesi di proteine. L’informazione genetica è sotto forma di codice, un codice genetico, basato sul fatto che
ogni filamento di acido nucleico è costituito da sequenze di adenina,
citosina, guanina e timina (A, C, G, T).